A litosfera
terra dividida em: crosta terrestre [sólido], manto [pastoso], núcleo externo [líquido] e núcleo interno [sólido].
Abundância dos elementos na crosta terrestre
o oxigênio é o mais abundante, pois está nos minérios e na água.
silicio: areia
aluminio: bauxita
hidrogênio: água
sódio: sal
Minérios
compostos que apresentam um elemento que pode ser comercializado.
ex: Al2O3.2H2O = bauxita
Pbs = galena
NaCl = sal-gema
Fe3O4 = magnetita
Elementos nativos
elementos que são encontrados puros na natureza.
ex: cobre, prata, ouro.
Rochas
parte externa da crosta terrestre e sólida. formada pelo esfriamento de massa ígnea e normalmente apresenta minério em sua constituição. Tipos:
rocha magmática: formada pelo resfriamento do magma.
Extrusiva; formada quando a lava vem para a superficie e esfria rapidamente. em sua composição contem pequenos cristais. Ex: basalto
Intrusiva; a lava se esfria no interior da terra. ocorrendo de forma lenta e formando cristais grandes. Ex: granito.
Rochas sedimentares: formadas a partir de restos de seres vivos ou de outras rochas, onde há composição desses materiais em camadas. Ex: arenito.
Rochas metamórficas: fomada a partir de alta pressão e temperatura elevada que atuam em outras rochas modificando-as. ex: mármore.
Fósseis
material orgãnico encontrado no interior de rochas sedimentares.
Mineral
formação sólida que apresenta em sua constituição algum metal viavel economicamente.
Alumínio
metal sólido na temperatura ambiente, maleável, ductil, cinza e brilhante.
P.F: 660ºC e P.E: 1.800ºC baixa densidade.
obtensão: o Al é obtido pela eletrólise da bauxita.
utilização: fios de alta tensão, esquadrias metálicas, embalagens, latas, etc.
Cobre
metal vermelho, maleável, ductil, condutor de corrente elétrica.
P.F: 1083ºC P.E: 2570ºC. baixa densidade.
obtensão: obtido a partir do minério calcosita ou calcopirita pelo método da ustulação.
o cobre obtido pela ustulação é purificado atraves da eletrólise.
utilização: condutor eletrico, fabricação do bronze, fabrização de mootor elétrico...
Cinética Química
estuda a velocidade e o comportamento das moléculas de uma reação quimica.
achar a velocidade média:
Fórmulas:
Vm = variação em mol/tempo ou
variação da concentração/tempo ou
variação em massa/tempo ou
variação em volume/tempo.
Teoria das colisões
toda reação ocorre com colisões, mas nem toda colisão gera uma reação.
condições fundamentais para que ocorra reação:
* Afinidade: tendência para reagir
* Contato: a mistura entre reagentes
condições acessórias:
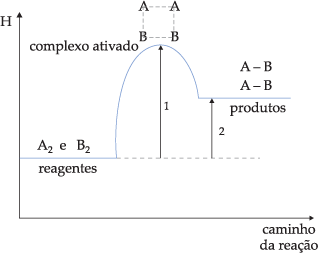
* energia de ativação: energia adicionada aos reagentes para dar inicio a reação. quanto maior a energia mais lenta a reação.
* choque efetivo: choque perfeito entre as moléculas, formando o complexo ativado.
Reação endotérmica
absorve energia.
Reação exotérmica
libera energia

Fatores que alteram a velocidade das reações
* superficie de contato: maior superficie maior velocidade.
* natureza dos reagentes: maior numero de ligações mais lenta.
* temperatura: maior temperatura maior velocidade.
lei de Gulberg Waage
o aumento da temperatura em 10ºC numa reação pode dobrar ou triplicar a velocidade de uma reação.
Catalisador
acelera a reação. diminui a energia de ativação. entra e sai da reação com a mesma formula molecular.
* Concentração dos reagentes
maior concentração maior velocidade.
lei de Gulberg Waage
a equação da velocidade de uma reação elementar é determinada pelo produto dos reagentes, elevados cada umao seu coeficiente.
Mecanismo de reação
reação quimica que ocorre em mais de uma etapa.
a equação da velocidade é determinada pela etapa mais lenta.

Nenhum comentário:
Postar um comentário